Para entender a química orgânica, é necessário que se tenha uma noção sobre a hibridação. A hibridação explica como alguns compostos fogem à regra do octeto, explica a formação de algumas ligações que seriam impossíveis segundo a teoria das ligações covalentes, assim como a geometria de certas moléculas.
Vamos nos focar nos tipos de hibridação que o Carbono faz, já que ele é o elemento base da química orgânica.
Vamos nos focar nos tipos de hibridação que o Carbono faz, já que ele é o elemento base da química orgânica.
- · Hibridação tetraédrica ou Sp3
No metano (CH4), o Carbono deve ser tetravalente. Mas a disposição eletrônica do Carbono na forma fundamental é: 1s² 2s² 2px¹ 2py¹, conforme o esquema abaixo:
G1
Então, o C deveria fazer apenas duas ligações, já que só tem dois orbitais semipreenchidos. Mas a molécula CH2 (metileno) é altamente reativa, não estando em equilíbrio. Aí que entra a hibridação.
Com a hibridação, um elétron do subnível 2s² passa pro subnível 2pz0, deixando o Carbono com a seguinte configuração:
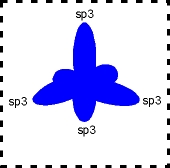
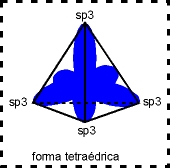
O Carbono então equilibra os orbitais (s ganha energia e p perde energia) formando orbitais com energia intermediária entre 2s e 2p, que chamamos de sp³, já que é a fusão de um orbital s com três p. O Carbono híbrido em sp³, portanto, tem a seguinte configuração:
Os orbitais ficam assim:
Nº de orbitais híbridos: 4
Ângulo entre orbitais híbridos: 109º 28’
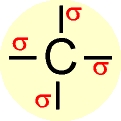
Saturação: Saturado, com 4 ligações σ (apenas ligações simples)
Saturação: Saturado, com 4 ligações σ (apenas ligações simples)
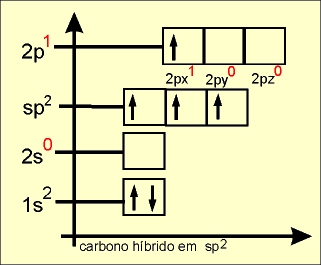
- Hibridação trigonal plana ou sp²
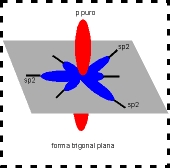
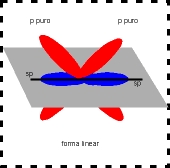
A hibridação sp² ocorre quando um dos orbitais p não hibridiza. Acontece em moléculas como a do eteno (CH2 =CH2), onde há uma dupla entre carbonos. Esse orbital p que não participa da hibridação é chamado de p puro, faz uma ligação π em um plando diferente dos híbridos, assim a geometria fica sendo trigonal plana, conforme a figura a seguir.
O carbono híbrido em sp² fica com a seguinte disposição:
Nº de orbitais híbridos: 3
Número de orbitais "p puro" = Um, perpendicular ao plano trigonal
Ângulo entre orbitais híbridos: 120º
Saturação: Insaturado, com 3 ligações σ e uma π (três ligações simples e uma dupla)
Número de orbitais "p puro" = Um, perpendicular ao plano trigonal
Ângulo entre orbitais híbridos: 120º
Saturação: Insaturado, com 3 ligações σ e uma π (três ligações simples e uma dupla)
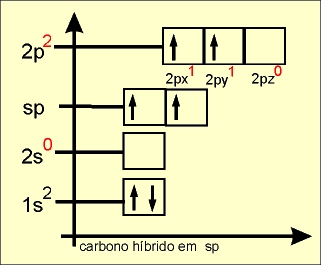
- Hibridação linear ou sp
A hibridação sp ocorre quando dois orbitais p não hibridizam. Assim, apenas um orbital p e um s são híbridos, adotando a geometria linear. Essa geometria é encontrada em moléculas onde o Carbono faz duas ligações do tipo π (duas duplas ou uma tripla), como no Etino (CH≡CH).
A figura seguinte mostra como fica o carbono hibrido em sp fica disposto:
Nº de orbitais híbridos: 2
Número de orbitais "p puro" = Dois, perpendiculares ao plano linear e perpendiculares entre si.
Ângulo entre orbitais híbridos: 180º
Saturação: Insaturado, com duas ligações σ e duas π (duas ligações simples e uma tripla/duas duplas)
Número de orbitais "p puro" = Dois, perpendiculares ao plano linear e perpendiculares entre si.
Ângulo entre orbitais híbridos: 180º
Saturação: Insaturado, com duas ligações σ e duas π (duas ligações simples e uma tripla/duas duplas)
G1



Obrigado por usar minhas imagens.
ResponderExcluirShow
ResponderExcluir